هالیدهای فلزی

هالیدهای فلزی ترکیباتی هستند که بین فلزات و هالوژنها به وجود میآیند. برخی از اینها، مانند سدیم کلرید، یونی هستند در حالی که برخی دیگر از طریق پیوند کووالانسی متصل میشوند. تعداد کمی از هالیدهای فلزی به صورت مولکولهای جداگانه وجود دارند، مانند هگزافلوراید اورانیوم، اما اکثر آنها ساختارهای پلیمریک را اتخاذ میکنند، مانند کلرید پالادیوم.[۱][۲]
آمادهسازی[ویرایش]
هالوژنها همگی میتوانند با فلزات واکنش دهند و با توجه به معادله زیر هالیدهای فلزی بسازند:
- 2M + nX2 → 2MXn
که در آن M فلز، X هالوژن، و MXn هالید فلزی هستند.

در عمل، این نوع واکنش ممکن است بسیار اکسوترمی باشد، بنابراین به عنوان یک تکنیک آمادهسازی عملی غیرقابل استفاده باشد. علاوه بر این، بسیاری از فلزات واسطه قادرند استاتههای اکسایشی متعددی بپذیرند که موضوعات را پیچیدهتر میکند. از آنجا که هالوژنها اکسایندههای قوی هستند، ترکیب مستقیم عناصر معمولاً به تشکیل هالید فلزی با اکسایش بالا منجر میشود. به عنوان مثال، کلرید فریک تا این شکل تهیه میشود، اما کلرید فریس به راحتی تهیه نمیشود. گرمکردن هالیدهای بالاتر ممکن است به تشکیل هالیدهای پایینتر منجر شود؛ این اتفاق به وسیله تجزیه حرارتی یا ناسپرده اتفاق میافتد. به عنوان مثال، کلرید طلا (III) به کلرید طلا (I) منتقل میشود:[۱]
- AuCl3 → AuCl + Cl2 at 160°C
هالیدهای فلزی نیز با نترالیزه اکسید فلز، هیدروکسید یا کربنات با هالوآسید مناسب تهیه میشوند. به عنوان مثال با هیدروکسید سدیم:[۱]
- NaOH + HCl → NaCl + H2O
گاهی اوقات میتوان آب را با گرما، خلوص، یا حضور اسیدهالوژنید بیآب کرد. هالیدهای فلزی بدون آب که برای تهیه ترکیبات هماهنگی دیگر مناسب هستند میتوانند با استفاده از ترکیب با تیونیل کلرید خشک شوند:[۱][۳]
- MCln·xH2O + x SOCl2 → MCln + x SO2 + 2x HCl
یونهای نقره و تالیوم (I) علاقه بسیاری به یونهای هالید در محلول دارند و هالید فلزی به صورت کمی از محلول آبی ایجاد میشود. این واکنش به حدی قابل اعتماد است که نیترات نقره برای آزمایش حضور و مقدار یونهای هالید استفاده میشود. واکنش یونهای نقره با یونهای برمید:
- Ag+ (aq) + Br− (aq) → AgBr (s)
برخی از هالیدهای فلزی ممکن است با واکنش اکسیدها با هالوژنها در حضور کربن کاهش کربوترمال تهیه شوند:
- TiO
2 + 2Cl
2 + C → TiCl
4(l) + CO
2(g)
ساختار و واکنشپذیری[ویرایش]

هالیدهای فلزی "یونی" (بهویژه هالیدهای فلزات قلیایی و قلیایی خاکی) معمولاً دارای نقاط ذوب و جوش بسیار بالایی هستند. آنها به راحتی در آب حل میشوند و برخی از آنها خاصیت جذب رطوبت دارند. معمولاً در حلالهای آلی کم محلول هستند.
برخی از فلزات انتقالی با حالت اکسایش پایین دارای هالیدهایی هستند که به خوبی در آب حل میشوند، مانند کلرید فروس، کلرید نیکلوس، و کلرید کوپریک. یونهای فلزی با حالت اکسایش بالا تمایل به هیدرولیز دارند، به عنوان مثال کلرید فریک، کلرید آلومینیوم، و تتراکلرید تیتانیوم.[۱]
هالیدهای فلزی منفرد (جداگانه) نقاط ذوب و جوش پایینتری دارند. به عنوان مثال، تتراکلرید تیتانیوم در دمای -25 درجه سانتیگراد ذوب میشود و در 135 درجه سانتیگراد به جوش میآید، که باعث میشود در دمای اتاق مایع باشد. آنها معمولاً در آب نامحلول هستند، اما در حلالهای آلی محلول میباشند.[۱]
هالیدهای فلزی پلیمری معمولاً نقاط ذوب و جوش بالاتری نسبت به هالیدهای فلزی مونومری دارند، اما پایینتر از هالیدهای فلزی یونی. آنها تنها در حضور یک لیگاند که واحدهای جداگانهای را آزاد میکند، محلول هستند. به عنوان مثال، کلرید پالادیم در آب بسیار نامحلول است، اما در محلول کلرید سدیم غلیظ به خوبی حل میشود:[۴]
- PdCl2 (s) + 2 Cl− (aq) → PdCl42− (aq)
کلرید پالادیم در بیشتر حلالهای آلی نامحلول است، اما با استیل نیتریل و بنزونیتریل واحدهای مونومری محلول تشکیل میدهد:[۵]
- [PdCl2]n + 2n CH3CN → n PdCl2(CH3CN)2
تتراهالیدهای چهاروجهی از فلزات انتقالی ردیف اول با اضافه کردن یک کلرید آمونیوم چهارتایی به هالید فلزی به شیوهای مشابه تهیه میشوند:[۶][۷]
- MCl2 + 2 Et4NCl → (Et4N)2MCl4 (M = Mn, Fe, Co, Ni, Cu)
پنتافلورید آنتیموان یک اسید لوئیس قوی است. با فلورید هیدروژن، اسید فلوروآنتیموانیک را تشکیل میدهد که قویترین اسید شناخته شده است. پنتافلورید آنتیموان به عنوان اسید لوئیس نمونهای استفاده میشود تا برای مقایسه پایهگرایی لوئیس مختلف ترکیبات به کار رود. این معیار از پایهگرایی به عنوان شماره دهندهی دهنده گوتمن شناخته میشود.[۸]
لیگاندهای هالید[ویرایش]
| ترکیب | رنگ | آرایش الکترونی | هندسه |
|---|---|---|---|
| [TiCl4] | بیرنگ | (t2g)0 | تتراهدرال |
| [Ti2Cl10]2− | بیرنگ | (t2g)3 | بیوکتاهدرال |
| [TiCl6]2− | زرد | (t2g)0 | اکتاهدرال |
| [CrCl6]3− | ?? | (t2g)3 | اکتاهدرال |
| [MnCl4]2− | صورتی روشن | (eg)2(t2g)3 | تتراهدرال |
| [FeCl4]2− | بیرنگ | (eg)3(t2g)3 | تتراهدرال |
| [CoCl4]2− | آبی | (eg)4(t2g)3 | تتراهدرال |
| [NiCl4]2− | آبی | (eg)4(t2g)4 | تتراهدرال |
| [CuCl4]2− | سبز | (eg)4(t2g)5 | تتراهدرال |
| [PdCl4]2− | قهوهای | d8 | صفحهای مربع |
| [PtCl4]2− | صورتی | d8 | صفحهای مربع |
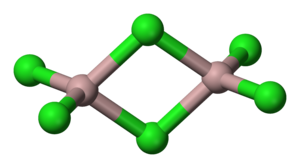
هالیدها به عنوان لیگاندهای نوع X در شیمی هماهنگی عمل میکنند. این هالیدها معمولاً دهندههای خوب σ و π هستند. این لیگاندها بیشتر به صورت پایانی هستند، اما ممکن است به عنوان لیگاندهای پلزن نیز عمل کنند. به عنوان مثال، لیگاندهای کلرید در کلرید آلومینیوم، دو مرکز آلومینیوم را به هم پیوند میدهند، بنابراین ترکیبی با فرمول تجربی AlCl3، در واقع در شرایط معمولی فرمول مولکولی Al2Cl6 دارد. به دلیل پایهگرایی پی، لیگاندهای هالید لیگانهای ضعیف میدانی هستند. به دلیل انرژی کمتر تقسیم میدان کریستالی، ترکیبهای هالیدی سری اول انتقال همیشه در حالت اسپین بالا هستند، زمانی که امکانپذیر است. این کمپلکسها برای سری دوم و سوم انتقالی، حالت اسپین پایین دارند. تنها کمپلکس [CrCl6]3− دارای تبادل غیرفعال است.
کمپلکسهای هالید فلزی همولپتیک با چندین استوکیومتری شناخته شدهاند، اما مهمترین آنها هگزاهالومتالاتها و تتراهالومتالاتها هستند. هگزاهالیدها هندسه هماهنگی هشت وجهی اتخاذ میکنند، در حالی که تتراهالیدها معمولاً چهاروجهی هستند. تتراهالیدهای چهار وجهی با هندسه مربع صفحهای نیز شناخته شدهاند و همچنین نمونههایی با هماهنگی 2 و 3 وجود دارد.
آلفرد ورنر مطالعه بر هگزامینکوبالت(III) کلراید انجام داد و اولین کسی بود که ساختارهای صحیح کمپلکسهای هماهنگی را پیشنهاد کرد. سیسپلاتین، cis-Pt(NH3)2Cl2، یک داروی پلاتینی است که دو لیگان کلرید دارد. دو لیگان کلرید به راحتی جایگزین میشوند، که این امر به مرکز پلاتین اجازه میدهد تا به دو واحد گوانین متصل شود و در نتیجه DNA آسیب ببیند.
به دلیل وجود اوربیتالهای پر شده pπ، لیگاندهای هالید روی فلزات انتقالی قادر به تقویت π-بازپسدادن به یک π-اسید هستند. همچنین شناخته شده است که آنها لیگاندهای cis را ناپایدار میکنند.[۹]
در تنظیم خلوص تیتانیوم، از دمای جوش بالای کمپلکسهای تتراکلرید و تتراایودید تیتانیوم (IV) در فرآیند کرول و فرآیند ون آرکل-دو بور به ترتیب بهرهبرداری میشود.
هالیدهای فلزی به عنوان اسیدهای لوئیس عمل میکنند. کلریدهای فریک و آلومینیوم کاتالیزورهای واکنش فریدل-کرفتس هستند، اما به دلیل هزینه پایین آنها، معمولاً به مقادیر استویکیومتریک اضافه میشوند.
اسید کلرپلاتینیک (H2PtCl6) یک کاتالیزور مهم برای هیدروسیلیلاسیون است.
پیشسازی ترکیبات غیر آلی[ویرایش]
هالیدهای فلزی معمولاً پیشسازهای آسان دسترس برای ترکیبات غیر آلی هستند. همانطور که در بالا ذکر شد، ترکیبات هالیدها میتوانند توسط گرما، خلوص یا تیونیل کلراید، بیآب شوند. لیگاندهای هالید ممکن است توسط نقره(I) جدا شوند، معمولاً به عنوان تترافلوئوروبورات یا هگزافلوئوروفسفات. در بسیاری از ترکیبات فلزات انتقالی، سایت هماهنگی خالی توسط یک حلال هماهنگی مانند تتراهیدروفوران تثبیت میشود. لیگاندهای هالید همچنین ممکن است توسط نمک قلیایی یک لیگاند از نوع X خارج شوند، مانند یک لیگاند نمونه salen-type.[۱۰] این واکنش به صورت رسمی یک ترانسمتالیشن است و جدایی لیگاند هالید توسط ایجاد یک هالید قلیایی در یک حلال آلی ترکیب میشود. هالیدهای قلیایی معمولاً انرژی شبکه بسیار بالایی دارند.
به عنوان مثال، سدیم سایکلوپنتادیئید با کلرید فروس به فروسن منجر میشود:[۱۱]
- 2 NaC5H5 + FeCl2 → Fe(C5H5)2 + 2 NaCl
هرچند ترکیبات غیر آلی استفاده شده برای کاتالیز ممکن است آماده و ایزوله شوند، اما در برخی موارد ممکن است در محل ایجاد شوند توسط افزودن هالید فلز و لیگاند مورد نظر. به عنوان مثال، کلرید پالادیم و تریفنیلفسفین ممکن است به جای کلرید بیس(تریفنیلفسفین)پالادیم(II) در واکنشهای جفتشدن پالادیم بهکار روند.
لامپها[ویرایش]
برخی از هالیدها در لامپ متالهالید استفاده میشوند.
جستارهای وابسته[ویرایش]
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ ۱٫۲ ۱٫۳ ۱٫۴ ۱٫۵ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. pp. 819–824. ISBN 0080379419.صفحه پودمان:Citation/CS1/en/styles.css محتوایی ندارد.
- ↑ خطای لوآ در پودمان:Citation/CS1/en/Identifiers در خط 47: attempt to index field 'wikibase' (a nil value).
- ↑ خطای لوآ در پودمان:Citation/CS1/en/Identifiers در خط 47: attempt to index field 'wikibase' (a nil value).
- ↑ Daniele Choueiry; Ei-ichi Negishi (2002). "II.2.3 Pd(0) and Pd(II) Complexes Containing Phosphorus and Other Group 15 Atom Ligands" (Google Books excerpt). In Ei-ichi Negishi. Handbook of Organopalladium Chemistry for Organic Synthesis. John Wiley & Sons, Inc. ISBN 0-471-31506-0. Unknown parameter
|name-list-style=ignored (help)صفحه پودمان:Citation/CS1/en/styles.css محتوایی ندارد. - ↑ خطای لوآ در پودمان:Citation/CS1/en/Identifiers در خط 47: attempt to index field 'wikibase' (a nil value).
- ↑ خطای لوآ در پودمان:Citation/CS1/en/Identifiers در خط 47: attempt to index field 'wikibase' (a nil value).
- ↑ خطای لوآ در پودمان:Citation/CS1/en/Identifiers در خط 47: attempt to index field 'wikibase' (a nil value).
- ↑ خطای لوآ در پودمان:Citation/CS1/en/Identifiers در خط 47: attempt to index field 'wikibase' (a nil value).
- ↑ J. F. Hartwig (2009). "4: Covalent (X-Type) Ligands Bound Through Metal-Heteroatom Bonds". Organotransition Metal Chemistry. ISBN 978-1-891389-53-5.صفحه پودمان:Citation/CS1/en/styles.css محتوایی ندارد.
- ↑ خطای لوآ در پودمان:Citation/CS1/en/Identifiers در خط 47: attempt to index field 'wikibase' (a nil value).
- ↑ الگو:OrgSynth
This article "هالیدهای فلزی" is from Wikipedia. The list of its authors can be seen in its historical and/or the page Edithistory:هالیدهای فلزی. Articles copied from Draft Namespace on Wikipedia could be seen on the Draft Namespace of Wikipedia and not main one.
